
VOLUMEN: XI NÚMERO: 29 - 30

VOLUMEN: XI
NÚMERO: 29 - 30
Animo deprimido y niveles séricos de IL-6, IL-12 y TNFα en Cáncer de pulmón no microcítico.
Pedro T. Sánchez
Rafael Sirera
Gema Peiró
Julia M. Sánchez
Francisco Palmero
Ana Blasco
Carlos Camps
Pilar Blasco
La tristeza y el humor deprimido como síntoma es muy habitual entre los pacientes con cáncer de pulmón no microcítico durante el proceso de tratamiento oncológico. Por otra parte, la prevalencia de la depresión como entidad clínica parece ser significativa entre estos pacientes. Aunque las tasas publicadas varían considerablemente (Hopwood & Stephens, 2000; Uchitomi et al, 2000 y 2003), podemos encontrar que hasta un 13% de los pacientes según los criterios utilizados la padecen. La depresión medida a través de pruebas específicas solamente puede considerarse orientativa de la existencia de un trastorno (casos probables), puesto que desde una perspectiva psicopatológica estricta (DSMIV o CIE10) el diagnóstico solo puede ser criterial (Sánchez et al, 2008a).
En la última década se han publicado numerosas aportaciones sobre la relación entre el sistema inmunológico y los estados de ánimo (Connor & Leonard, 1998; Licinio & Wong, 1999; Kronfol y Remick, 2000; Reiche et al. 2004). El puente teórico para relacionarlos estaría conformado por las interleucinas (especialmente las pro-inflamatorias) que son capaces de interactuar con los Sistemas Endocrino, Noradrenérgico, Serotoninérgico y Dopaminérgico (Sánchez et al, 2008b). Por otra parte, la depresión puede alterar la función del sistema inmune de forma que podría influenciar el desarrollo de la inflamación que se ha asociado (Coussens, 2003) al crecimiento de los tumores neoplásicos.
El propósito de la presente investigación era explorar la existencia de diferencias significativas entre los niveles séricos de tres interleucinas IL 6, IL-12 y la TNF-α, (cuyas fuentes y propiedades de acción pueden verse en la tabla 1) en sujetos sanos y en pacientes con cáncer de pulmón no microcítico y la posible relación entre la depresión medida a través de una escala (ánimo deprimido) y esos niveles.
TABLA 1.- Fuente y Acción de la Interleucinas utilizadas
|
Interleucinas |
Fuente |
Acción |
||
|
IL-6 |
Macrófagos activados, Monocitos, Fibroblastos y las Células del endotelio vascular. |
Principal regulador de la respuesta inmunológica y de reacciones de fase aguda, interviene también en la hematopoyesis. Tiene propiedades proinflamatorias y antiinflamatorias, predominando la acción antiinflamatoria. |
||
|
IL-12 |
Linfocitos B. |
Induce la síntesis de IFN-g e IL-2 por los LTh1 e inhibe la producción de IL-4, IL-5 e IL-10 por los LTh2. Además activa las células NK y aumenta la expresión de receptores para la IL-18. |
||
|
TNFα |
Macrófagos, Monocitos y Linfocitos T. |
Tiene efecto anti-tumoral y actúa como mediador en el desarrollo del shock séptico y de la caquexia en enfermedades crónicas. Además activa potentemente a los Macrófagos, estimula la producción de citocinas por muchos tipos celulares e incrementa la permeabilidad vascular. |
||
|
|
|
|
|
|
MUESTRAS
Se conformaron tres grupos de muestras:
1. 80 pacientes Diagnosticados de Cáncer de pulmón no microcítico en estadio avanzado y tratamiento quimioterápico activo, tras firmar el correspondiente Consentimiento, fueron remitidos por los Oncólogos para participar en el estudio y formaron la Muestra Clínica. Por diferentes motivos metodológicos, esta muestra clínica se redujo a 74 casos válidos. La muestra estaba compuesta por 61 varones y 13 mujeres con una edad media de 61.8 años (IC95%, 60 – 63.6). Con estos 74 pacientes se realizaron 133 consultas: 74 primeras consultas, 34 segundas consultas, y 15 terceras consultas. Durante el periodo que duró el estudio fallecieron 37 de los 74 pacientes incluidos (50%), 8 pacientes renunciaron a seguir con su participación, 14 fueron retirados por su importante empeoramiento o por no acudir a las citas, y solamente 15 pacientes terminaron los 6 meses de estudio.
2. Las muestras séricas de 90 sujetos sanos formaron el primer grupo control.
3. Las muestras séricas de 102 pacientes diagnosticados también de Cáncer de pulmón no microcítico en estadio avanzado y tratamiento quimioterápico activo, que habían participado en otros estudios formaron el segundo grupo control.
INSTRUMENTOS
Se realizó una entrevista clínica semi-estructurada, de unos 15 minutos de duración, basada en la Versión Castellana de la Comprehensive Psychiatric Rating Scale (Asberg et al, 1978), a continuación se les administró la Montgomery Asberg Depression Rating Scale, (Montgomery & Asberg, 1979, Lobo et al, 2002) utilizando como punto de corte (para determinar casos probables de depresión) la puntuación de 25 (Sánchez et al, 2008a).
PROCEDIMIENTO
A los pacientes de la Muestra Clínica se les realizó la extracción de sangre periférica en ayunas para la obtención de los niveles de las interleucinas. Ese mismo día fueron entrevistados siguiendo el protocolo psicológico. La muestra sanguínea clínica fue codificada, se procedió a la separación del suero del paquete celular y fueron almacenadas a -80 ºC hasta su análisis. La determinación se realizó una vez finalizada la recogida total de muestras, mediante ELISA y lectura de la placa en el densitómetro óptico Biorad a una longitud de onda de 490 nm con referencia de 620 nm. Se compararon primero los niveles obtenidos de interleucinas en la muestra control 1 de sujetos sanos, con los niveles obtenidos en la muestra control 2 de sujetos con cáncer de pulmón no microcítico. Posteriormente comparamos los niveles obtenidos de interleucinas en la muestra control 2 de sujetos con cáncer de pulmón no microcítico con los niveles obtenidos en la muestra clínica de los 72 pacientes.
Convertimos la MADRS en una prueba binaria (0/1) utilizando el punto de corte 25, para realizar el correspondiente estudio estadístico.
ANÁLISIS ESTADÍSTICOS
Empleamos el paquete estadístico Statgraphic plus 5.1, se realizó un estudio estadístico con pruebas no paramétricas contrastadas con la distribución 0.5/0.5 obtenida al azar y posteriormente diversas pruebas paramétricas. Se incluyó entre otras medidas la evaluación de la asimetría y de la curtosis estandarizada, la desviación típica y cociente de varianzas, contraste W de Mann-Whitney (Wilcoxon) para comparar medianas y el contraste de Kolmogorov – Smirnov para comparar las distribuciones entre las muestras.
Como comentamos anteriormente, los pacientes entrevistados y considerados metodológicamente válidos fueron 74. Contamos pues con 74 primeras entrevistas y 34 segundas entrevistas. Dado el tamaño de la sub-muestra se decidió realizar un análisis de las correlaciones en la primera entrevista y posteriormente analizar la posible existencia de cambios evolutivos entre la primera entrevista (basal) y la entrevista realizada a los tres meses (2ª entrevista). Para hacerlo se procedió a transformar las puntuaciones directas obtenidas en la escala MADRS en puntuaciones binarias (0/1) utilizando como “gold standar” el punto de corte recomendado. Una vez realizada la conversión, se procedió a la comparación de las 2 muestras (prueba binaria – IL).
IL 6:
Encontramos diferencias significativas en los niveles de IL-6 entre los sujetos del grupo control sanos y los pacientes del grupo control de cáncer de pulmón. Los controles sanos presentan niveles séricos de IL-6 más reducidos que los pacientes con cáncer de pulmón no microcítico como puede observarse en la Tabla 2 y en la Figura 1.
TABLA 2. Principales estadísticos de las dos muestras para IL-6.
|
|
IL-6 Control Cáncer |
IL-6 Control Sanos |
|
Media |
13,6101 |
4,34987 |
|
Mediana |
6,74 |
1,43 |
|
Varianza |
359,499 |
137,561 |
|
Desviación Típica |
18,9605 |
11,7286 |
|
Mínimo |
0,0 |
0,0 |
|
Máximo |
111,85 |
80,33 |
|
Asimetría Tipificada |
10,3845 |
19,3419 |
|
Curtosis Tipificada |
19,0267 |
55,3617 |
Figura 1. Curva de Densidad de los grupos control con cáncer (CC) y el grupo sano (CS).
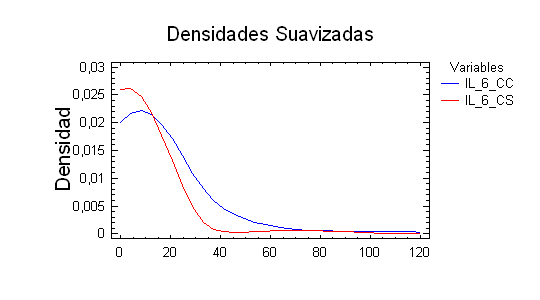
Ambas muestras presentan diferencias estadísticamente significativas para un nivel de confianza del 95,0% entre las medias (valor 0,00031545; t-test), entre las desviaciones típicas (1,66928 hasta 4,09409; F-test), entre las medianas (P-Valor = 9,80304E-8; W de Mann-Whitney (Wilcoxon) y entre las distribuciones de las dos muestras (P-Valor aproximado = 5,0848E-9; Kolmogorov-Smirnov). Por el contrario, no encontramos diferencias estadísticamente significativas entre la muestra control de pacientes con cáncer y la muestra del grupo clínico de nuestros pacientes con cáncer.
No existen diferencias estadísticamente significativa para un nivel de confianza del 95,0% entre las medias (valor 0,233573; t-test), entre las desviaciones típicas (0,714753 hasta 1,75301; F-test), ni entre las medianas (P-Valor = 0,0563744; W de Mann-Whitney (Wilcoxon) de las dos muestras control (Sanos y Cáncer de pulmón). Tampoco encontramos diferencias estadísticamente significativas entre la muestra control de pacientes con cáncer y la muestra del grupo clínico de pacientes con cáncer.
Encontramos que existen diferencias estadísticamente significativa para un nivel de confianza del 95,0% entre las medianas (P-Valor = 0,0117136; W de Mann-Whitney (Wilcoxon) y entre las distribuciones de las dos muestras (P-Valor aproximado = 0,0000550527; Kolmogorov-Smirnov). Ver Tabla 3 y Figura 2.
TABLA 3. Principales estadísticos en las dos muestras para TNFα.
|
|
TNFα Control Cáncer |
TNFα Control Sanos |
|
Media |
19,8575 |
26,0999 |
|
Mediana |
9,805 |
5,46 |
|
Varianza |
1145,22 |
5163,15 |
|
Desviación Típica |
33,841 |
71,855 |
|
Mínimo |
0,0 |
0,0 |
|
Máximo |
171,37 |
463,84 |
|
Asimetría Tipificada |
13,3752 |
18,5302 |
|
Curtosis Tipificada |
21,254 |
48,343 |
Figura 2. Curva de Densidad de los grupos control con cáncer (CC) y el grupo sano (CS).
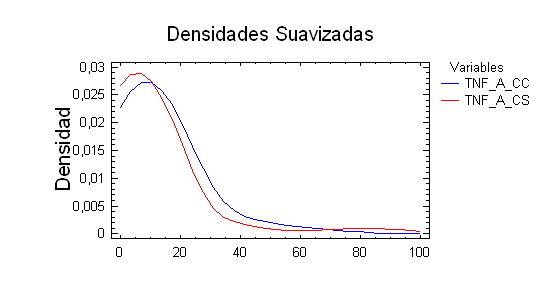
No encontramos diferencias estadísticamente significativas entre la muestra control de pacientes NSCLC y la muestra del grupo clínico de pacientes NSCLC.
Analizamos la sub-muestra de 34 pacientes a los que se realizaron extracciones séricas en el punto basal y a los 3 meses, no encontramos en ninguna de las tres citoquinas diferencias estadísticamente significativas para un nivel de confianza del 95,0%.
· Relación entre los niveles séricos de la IL-6, IL-12, y TNFα y los resultados de la escala MADRS:
En la comparación realizada entre los niveles séricos de las interleucinas IL-6, IL-12 y el TNFα, y la puntuaciones obtenida en la escala MADRS transformada en prueba binaria no hemos encontramos diferencias estadísticamente significativas para un nivel de confianza del 95,0%.
Analizando la sub-muestra de 34 pacientes a los que se realizaron entrevistas psicológicas en el punto basal y a los 3 meses, no encontramos diferencias estadísticamente significativas para un nivel de confianza del 95,0%, en la puntuación de la escala MADRS transformada en Binaria.
Hemos decidido publicar los resultados obtenidos en la presente investigación, con las limitaciones asociadas al tamaño de la muestra, porque a pesar de no haber obtenido relaciones estadísticamente significativas entre el MADRS y los niveles séricos de las citocinas analizadas, se enmarcan en el intento de clarificar las complejas relaciones de dos procesos paralelos que se producen en el desarrollo del cáncer de pulmón no microcítico: el proceso inmunológico y el proceso emocional. Los datos acumulados en la literatura sugieren la existencia de tendencias en la evolución de los niveles séricos de las citocinas en relación con el estado de ánimo y viceversa.
Sabemos que la inflamación crónica es un proceso bioquímico que se produce como resultado de la presencia durante un tiempo prolongado de algún agente infeccioso, antígeno o de un trastorno del sistema inmunológico. El inicio de la respuesta inmune lo generan las células del sistema inmunológico inespecífico (neutrófilos, macrófagos y dendríticas), que inducen la respuesta inmune específica para dar una respuesta especializada y con capacidad de memoria. Cada vez disponemos de más datos que sugieren que la inflamación crónica puede contribuir al desarrollo del cáncer de pulmón (Ramanakumar et al 2006; Engels et al, 2007). Entre los mediadores presentes desde el inicio en la inflamación crónica debemos destacar el papel de la TNFα precursora de secuencias de actividades que buscan la liberación y utilización de la glucosa, induciendo la producción de una segunda tanda de citocinas como IL-1, IL-6, IL-8 y el Macrophage Chemotactic Protein, derivados del ácido araquidónico o eicosanoides, el factor activador de las plaquetas (PAF), la liberación de radicales libres y la producción de óxido nítrico (NO), también de otras citocinas antiinflamatorias (IL-4 e IL-10) y la liberación (Nonaka,2001) de otras sustancias mediadoras de la inflamación como las bradiquininas. En los resultados encontrados en nuestro estudio obtenemos efectivamente una elevación de los niveles de TNFα en ambos grupos de pacientes con cáncer de pulmón no microcítico (control y clínico) frente a los niveles obtenidos en los sujetos sanos.
Elegimos la IL-6 por su capacidad de actuar sobre el eje HPA (Hipotalámico-Pituitario-Adrenal) (Chrousos, 1995) aumentando la secreción de corticotropina (ACTH) y cortisol. Algunos datos disponibles sugieren que podría activar también el sistema Locus Coeruleus – Norepinefrina del Eje SAM (Simpático-Adreno-Medular). Estimular las concentraciones plasmáticas de glucocorticoides, alterando la actividad de las neuronas noradrenérgicas hipotalámicas, y disminuyendo la norepinefrina en el bazo. La inflamación crónica podría así asociarse al estrés, siendo capaz de iniciar la cascada de procesos bioquímicos que la hacen formalmente indistinguible del propio proceso psicobiológico. La función reguladora-supresora de la respuesta inmune dependerá entonces del balance entre la síntesis de distintas citocinas con acciones diversas implicando a otros sistemas (Kronfol & Remick, 2000): Endocrino, Noradrenérgico, Serotoninérgico y Dopaminérgico. En nuestros datos también encontramos un incremento en los niveles séricos en ambos grupos de pacientes (control y clínico) con cáncer de pulmón no microcitico frente a los niveles obtenidos en los sujetos sanos.
Al ser el estrés inflamatorio inmunomodulador, se ha planteado la posible existencia de un patrón de inhibición de la respuesta inmune celular (Th1) mientras se incrementa la inmunidad humoral (Th2) o viceversa (Agarwal & Marshall, 1998; Singh et al 1999). Las Th1 producen (IFN-γ, TNF-β) activadores de macrófagos; en contraste las Th2 producen IL-4, IL-5, IL-10, y IL-13 activadoras de la respuesta de los anticuerpos, aunque no podemos descartar la existencia de otros modelos. La IL-12 la escogimos precisamente por ser una interleucina pro-inflamatoria, activadora de las células T del tipo 1 (Th1), capaz de mejorar la capacidad del sistema inmunitario para destruir las células tumorales y de interferir el flujo de la sangre al tumor. Sin embargo en nuestro estudio no hemos encontrado que sus niveles séricos difieran estadísticamente entre los pacientes y los controles sanos.
Las evidencias que sostienen la relación entre citocinas y depresión en el campo oncológico proceden de la observación clínica de pacientes en tratamiento con interferones (Asnis & La Garza, 2005): interferón-α en Melanoma, interferon-γ en el Sarcoma de Kaposi o de la interleucina-2 en Cáncer Metastásicos. Otras evidencias que sugieren el rol del sistema inmune en el desarrollo y la consolidación de la depresión incluyen las observaciones de que los pacientes deprimidos muestran: elevados niveles de IL-6 (Maes et al, 1993), elevados marcadores de activación de las células inmunes, así como función inmune alterada. Las citocinas podrían ejercer un efecto depresivo directamente por medio de la activación de la hormona liberadora de corticotropina o indirectamente provocando resistencia de los receptores de glucorticoides, lo que causa hiperactividad del eje hipotálamo-hipofisiario-suprarrenal, debido a inhibición del mecanismo de retroalimentación normal.
No hemos encontrado en nuestro trabajo relación entre las citocinas analizadas y el MADRS. Uno de los factores que impidieron realizar un análisis con pruebas paramétricas fue el limitado número de pacientes de la muestra clínica que superaban el punto de corte establecido en la prueba (casos probables), número que se reducía sensiblemente si utilizábamos los criterios clínicos CIE-10 para Episodio Depresivo. Los porcentajes obtenidos en nuestra muestra (casos probables y casos clínicos) están dentro de los márgenes previamente publicados. Posteriores investigaciones requerirán reclutar una muestra suficientemente amplia de pacientes con diagnóstico de depresión. El hecho de que no encontrar cambios significativos en el estado de ánimo deprimido de los pacientes durante los primeros ciclos de tratamiento quimioterápico, en nuestro caso entre la entrevista basal y la segunda realizada a los tres meses, ya ha sido puesto de manifiesto utilizando la misma escala MADRS y la escala HADS (Neron et al, 2007).
Por último nos parece importante destacar a nivel metodológico que aunque el empleo de los Kits de ELISA para la determinación de los niveles de interleucinas séricas muestra una baja reproducibilidad entre laboratorios por la no disponibilidad de estándares y reactivos internacionales (Fahey et al, 2000), esta dificultad no cuestiona los resultados obtenidos en el mismo laboratorio.
· Agarwal SK, Marshall GDJ. (1998) Glucocorticoid induced type 1 type 2 cytokine alterations in humans: a model for stress-related immune disfunctions. J Interferon Cytokine Res 18:1059-1068.
· Asberg M, Montgomery SA, Perris C, Schalling D, Sedwall G. (1978) Comprehensive Psychopathological Rating Scale. Acta Psychiat Scand supl 271: 5 – 27.
· Asnis GM, La Garza R. (2005) Interferon-induced depression: strategies in treatment. Prog Neuropsychopharmacol Biol Psychiatry; 29:808-818.
· Chrousos GP. (1995) The hypothalamic-pituitary-adrenal axis and immune-mediated inflammation. N Engl J Med 332:1351-1362.
· Connor TL, Leonard BE. (1998) Depression, stress, and immunological activation. The role of cytokines in depresive disorders. Life Science; 7:583-606.
· Coussens LM, Werb Z, (2002) Inflammation and cancer. Nature 420: 860 -867.
· Engels EA, Wu X, Gu J, Dong Q, Liu J, Spitz MR. (2007) Systematic Evaluation of Genetic Variants in the Inflammation Pathway and Risk of Lung Cancer. Cancer Res 67:6520–6527.
· Fahey J, Aziz N, Spritzler S, Nishanian P, Lathey J, Seigel J, et al (2000). Need for an external proficiency testing program for cytokines, chemokines, and plasma markers of immune activation. Clin and Diag Lab Immunol 7: 540-548.
· Hopwood P, Stephens RJ. (2000) Depression in patients with lung cancer: prevalence and risk factors derived from quality-of-life data. J Clin Oncol 18:893 – 903.
· Kronfol z, Remick DG. (2000) Cytokines and the brain: implications for clinical psychiatry. Am J Psychiatry 157: 683 – 694.
· Licinio J, Wong ML. (1999) The role of infl ammatory mediators in the biology of major depresion: central nervous system cytokines modulate the biological substrate of depresive symptoms, regulate stress-responsive systems, and contribute to neurotoxicity and neurodegeneracion. Mol Psychiatry; 4:317 – 327.
· Lobo A, Chamorro L, Luque A, Dal-Ré R, Badia X, Baró E y GVPEEP. (2002) Validación de las versiones en español de la Montgomery- Asberg Depression Rating Scale y la Hamilton Anxiety Rating Scale para la evaluación de la depresión y de la ansiedad. Med Clin (Barc) 118: 493–499.
· Maes M, Scharpe S, Meltzer HY, Bosmans E, Suy E, Calabrese J, Cosyns P. (1993) Relationship between interleukin-6 activity, acute phase proteins, and the function of the hypothalamic-pituitaryadrenal axis in severe depression. Psychiatry Res 49:11-27.
· Montgomery SA, Asberg M. (1979) A new depression scale designed to be sensitive to change. Br J Psychiatry 134: 382-9.
· Neron S, Correa JA, Dajczman E, Kasymjanova G, Kreisman H, Small D. (2007) Screening for depressive symptoms in patients with unresectable lung cancer. Support Care Cancer 15: 1207 – 1212.
· Nonaka M. (2001) Evolution of the complement system. Curr Opin Immunol 13:69 -73.
· Ramanakumar A, Parent M , Menzies D , Siemiatycki J. (2006) Risk of lung cancer following nonmalignant respiratory conditions: Evidence from two case-control studies in Montreal, Canada. Lung Cancer 53: 5 – 12.
· Reiche EM, Nunes SO, Morimoto HK. (2004) Stress, depression, the immune system, and cancer. Lancet Oncol 5: 617-25.
· Sánchez PT, Peiró G, Corbellas C. (2008 a) ¿Evaluación de la psicopatología a través de escalas? Psicooncología 5: 71 – 81.
· Sánchez PT, Sirera R, Peiró G, Palmero F. (2008 b) Estrés, Depresión, Inflamación y Dolor. REME XI; 28.
· Singh VK, Mehrotra S, Agarwal SS. (1999) The paradigm of Th1 and Th2 cytokines: its relevance to autoimmunity and allergy. Immunol Res 20: 147-161.
· Uchitomi Y, Mikami I , Kugaya A, Akizuki N, Nagai K, Nishiwaki Y, Akechi T, Okamura H. (2000) Depression after successful treatment for nonsmall cell lung carcinoma A 3-month follow-up study Cancer 89: 1172 – 1179.
· Uchitomi Y, Mikami I, Nagai K, Nishiwaki Y, Akechi T, Okamura H. (2003) Depression and psychological distress in patients during the year after curative resection of non small cell lung cancer. J Clin Oncol 21: 69 – 77.